В перспективе это пригодится в поиске терапии для широкого спектра заболеваний, в том числе тех, которые на сегодняшний день считаются неизлечимыми
Сибирские ученые разработали универсальную платформу с
использованием генетически кодируемых биосенсоров, которая
позволит изучать механизмы возникновения различных патологий в
режиме реального времени на клеточных линиях человека, сообщает
издание «Наука в Сибири». В перспективе это пригодится в поиске
терапии для широкого спектра заболеваний, в том числе тех,
которые на сегодняшний день считаются неизлечимыми. Статья об
этом опубликована в журнале
Biochemistry (Moscow).
«Для моделирования различных патологических состояний
используются индуцированные плюрипотентные стволовые клетки
(ИПСК), — комментирует аспирантка лаборатории эпигенетики
развития ФИЦ “Институт цитологии и генетики СО РАН” Елизавета
Ивановна Устьянцева. — Фактически это аналоги эмбриональных
стволовых клеток, только полученные искусственным путем. Главная
особенность ИПСК — их плюрипотентность, то есть способность
образовывать все типы клеток живого организма. Мы можем в
условиях лаборатории заставить клетки вспомнить исходное
состояние (как в эмбрионе), когда они еще не дифференцировались,
то есть не выбрали определенную функцию в организме. Чтобы
перепрограммировать клетки, необходимы специфические методы по
активации в них спящих генов».
Ученые по всему миру создают ИПСК в лабораториях, но до сих пор
не было разработано общепринятых стратегий их использования для
биомедицинских задач. Основной сложностью работы с клеточными
моделями остается поиск подходящего метода для измерения степени
выраженности того или иного патологического процесса.
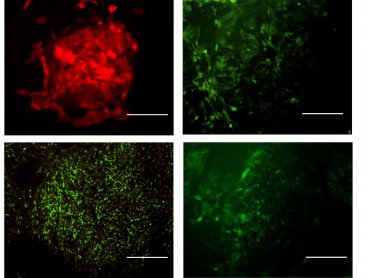
Для мониторинга внутриклеточных процессов и активности ферментов
в режиме реального времени новосибирские биологи предложили
использовать генетически кодируемые биосенсоры. «Они представляют
собой специфические молекулы, в нашем случае флуоресцентные,
которые под действием тех или иных стимулов меняют свои свойства.
Активируя биосенсоры в больных и здоровых клетках, мы можем
смотреть, по каким параметрам они отличаются», — говорит
Елизавета Устьянцева.
Биосенсоры встраиваются в геном клеток с помощью технологии
геномного редактирования CRISPR/Cas9. «Раньше сенсоры помещались
в клетки случайным образом, и была велика вероятность того, что
работа генома могла нарушиться и исказить результаты
исследования. Новый подход не влияет на функционирование клетки и
на интерпретацию результатов, поскольку последовательность
биосенсора прицельно встраивается в нужное, самое безопасное
место генома», — поясняет Елизавета Устьянцева.
Задача ученых — оценить влияние определенных молекул на развитие
заболевания. В частности, в своей статье они рассматривают
патологические процессы, связанные с боковым амиотрофическим
склерозом (БАС).
Исследования проводятся на двух клеточных линиях: полученной от
пациента с мутацией, приводящей к развитию БАС, и здоровой —
контрольной. «На основе этих линий ИПСК (в процессе
репрограммирования их получается несколько) мы создали панель из
пяти “больных” и пяти “здоровых” трансгенных клеточных линий,
которые имеют один источник, но отличаются последовательностью
биосенсора, встроенного в геном», — рассказывает
исследовательница.
Биосенсоры позволяют наблюдать за процессами, характерными для
нейродегенерации: окислительным стрессом (степень его
выраженности может быть оценена косвенно через определение уровня
содержания в цитоплазме перекиси водорода — промежуточного
продукта в реакциях утилизации активных форм кислорода),
апоптозом (степень его выраженности определяется активностью
одной из эффекторных каспаз 3 — фермента, играющего ключевую роль
в процессе программируемой клеточной гибели), а также стрессом
эндоплазматического ретикулума (ЭПР) (этот процесс запускается в
ответ на накопление патологических белков в клетке). «Мы
надеемся, что метод позволит нам увидеть достаточно четкую
разницу между больными и здоровыми клетками и удостовериться в
том, что модель заболевания, которую мы создали на основе ИПСК,
действительно подходит для изучения БАС», — говорит Елизавета
Устьянцева.
Поскольку патологические механизмы, лежащие в основе различных
нейродегенеративных заболеваний, во многом схожи, и те же самые
процессы (окислительный стресс, стресс ЭПР, гибель клеток
посредством апоптоза) наблюдаются и при других заболеваниях,
платформу можно также использовать для поиска лекарств от
спинальной мышечной атрофии, болезней Паркинсона, Альцгеймера,
Гентингтона и прочих. Исследования проводятся на стволовых
клетках, выделенных из периферической крови людей, поэтому в
качестве посредников может выступать широкий пул медицинских
центров, проводящих диагностику: предоставлять материал для
получения ИПСК с генотипом пациента (с его обязательного
информированного согласия). Процедура забора крови знакома людям
и обычно не вызывает дискомфорта.
«В будущем такую систему можно применять для тестирования
потенциальных лекарств, — отмечает Елизавета Устьянцева. — Мы
имеем клетки, которые расположены в разных лунках. Таких лунок
можно нарастить сотни, и в каждую капать какое-то действующее
вещество и проводить массовый скрининг — смотреть, как изменились
сигналы, получаемые от биосенсоров. Это поможет значительно
сократить процесс поиска и отбора препаратов, направленных на
лечение определенных заболеваний».
Исследовательница подчеркивает, что концепцию в перспективе можно
развивать в более широких масштабах — использовать не только для
мониторинга нейродегенеративных, но и других типов недугов, к
примеру кардиологических, поскольку биосенсоры активно
разрабатываются для широкого круга клеточных процессов.
В данный момент ученые готовят эксперимент по индукции
образования в клетках активных форм кислорода, чтобы проверить,
как клетки реагируют на этот параметр. «Мы уже владеем методикой
направленной дифференцировки стволовых клеток in vitro в моторные
нейроны — тип клеток, которые гибнут при БАС. В рамках нового
эксперимента мы планируем активировать биосенсоры в больных и
здоровых клетках и сравнить, насколько сильно они реагируют на
повышение концентрации активных форм кислорода. Это позволит
узнать, отличаются ли показатели в моторных нейронах в
стандартных условиях и в условиях стресса — при искусственно
индуцированной болезни», — комментирует Елизавета Устьянцева.
Иллюстрация: Биосенсоры в клетках в работе
Источник: www.sbras.info




