Исследователи работали с лабораторными мышами, но в перспективе планируют создать гуманизированные антитела для терапии людей
Специалисты Института химической биологии и фундаментальной
медицины СО РАН синтезировали белковые препараты (моноклональные
антитела), показавшие высокие результаты в лечении грибкового
заболевания — системного кандидоза, сообщает издание «Наука в
Сибири». Эффективность новых соединений проверялась авторами в
составе международной группы ученых. Исследователи работали с
лабораторными мышами, но в перспективе планируют создать
гуманизированные антитела для терапии людей.
Детали опубликованы в журнале
Plos One.
Системные грибковые заболевания, к которым относится кандидоз,
возникают обычно у пациентов функции иммунной системы
которых были нарушены, например, в результате интенсивного курса
химиотерапии, пересадки органов или заражения ВИЧ. Многие грибки,
в том числе аспергиллы, кандиды, обладают устойчивостью к
традиционно применяемым препаратам — антимикотикам. Лечение
последними переносится тяжелее, чем антибиотиками, потому что
грибы, как и люди, — эукариотические (ядерные) организмы, в
отличие от безъядерных бактерий — прокариот. В результате
средства, направленные на уничтожение грибковых заболеваний, в
значительной степени повреждают и человеческие клетки.
Ученые работали с синтетическим антигеном — олигосахаридом
β-глюканом, созданным в лаборатории химии гликоконъюгатов
Института органической химии им. Н. Д. Зелинского РАН. Применение
синтетического, а не природного соединения позволяет добиться
выработки антител специфичных именно к грибам, а также
предсказать состав и структуру антигена, что дает возможность
формировать антитела с определенными свойствами.
«У природных антигенов можно лишь приблизительно знать, что в них
содержится: например, есть глюканы, но непонятно, сколько их в
цепочке, разветвленные они или линейные. Структура синтетических
соединений полностью известна. Отталкиваясь от нее, можно
предположить, какой специфичностью будет обладать антитело и
будут ли у него нужные характеристики, в частности
терапевтические», — говорит первый автор статьи младший научный
сотрудник лаборатории молекулярной микробиологии ИХБФМ СО РАН
Андрей Леонидович Матвеев.
Антитела вырабатываются организмом в ответ на проникновение
чужеродных агентов — антигенов (например, возбудителей
инфекционных заболеваний) и, соответственно, даже введенные
извне, не вызывают негативной реакции. Моноклональные антитела —
продукт деятельности потомков одной и той же клетки иммунной
системы. Они высокоспецифичны: то есть связываются лишь с
определенным антигеном и, в зависимости от функции, могут
выявлять чужеродный агент или уничтожать его.
Сейчас на мировом фармацевтическом рынке используется около 100
препаратов на основе моноклональных антител, ими в основном лечат
раковые и аутоиммунные заболевания; пока есть только два
противоинфекционных антитела: одно из них направлено на
уничтожение вируса, другое — токсина бактерии.
Получение моноклональных антител происходит в несколько стадий:
лабораторным мышам вводится антиген, затем из селезенок животных
с хорошим иммунным ответом выделяются клетки, продуцирующие
антитела, и сливаются с клетками раковой линии мышей. В
результате получаются практически бессмертные культуры, которые
могут долго производить нужные вещества.
«Сложность в том, что не всегда у мышей есть требуемая реакция на
введенный антиген. Андрей Матвеев добился того, чтобы иммунный
ответ был сильный, после чего получил отдельные клеточные клоны и
выбрал те из них, что обладают наибольшей эффективностью
связывания с антигеном. Их получилось не так много, но два
антитела из отобранных продемонстрировали способность защитить
мышей, зараженных смертельной дозой грибка Candida. После разовой
инъекции одним из антител 50% животных выжили, это очень хороший
показатель. Результативность другого соединения была ниже, но
тоже значимая, к тому же любой курс лечения подразумевает серию,
а не однократное введение лекарственного препарата», —
комментирует соавтор статьи в Plos One заведующая лабораторией
молекулярной микробиологии ИХБФМ СО РАН доктор биологических наук
Нина Викторовна Тикунова.
Эксперименты in vitro выявили и хорошую противогрибковую
активность комбинации более эффективного антитела и антимикотика
флуконазола. При этом оба действующих вещества были взяты в
низких концентрациях, когда каждое из них по отдельности не
оказывало лечебного эффекта.
Конечно, молекулы, полученные с помощью экспериментов на мышах,
не будут вводиться людям, для этого конструируются
гуманизированные химерные антитела, которые, предположительно,
будут обладать терапевтической активностью в отношении системного
кандидоза.
Гуманизированное антитело — изначально человеческое, но небольшие
фрагменты этого белка заменены на аналогичные из тех антител
мыши, которые в экспериментах на модельных животных показали свою
перспективность.
«Работающие на мышах антитела проходят проверку на более крупных
млекопитающих (кроликах, собаках, шимпанзе), и на каждом этапе
происходит отсев препаратов, но в первую очередь это касается
противораковых лекарств. В отличие от последних, средства на
основе антимикробных антител, эффективные для грызунов, как
правило, действенны и для человека при условии доказанной
безопасности. Поэтому есть надежда, что если гуманизировать
полученное нами соединение, его в перспективе можно будет
применять и для лечения людей», — поясняет Нина Тикунова.
В дальнейших планах исследовательской группы — более подробное
изучение новых антител и разработка терапевтической схемы лечения
на лабораторных животных. Для того, чтобы препараты попали на
рынок лекарственных средств, разрешенных к применению на людях,
нужно провести доклинические и клинические исследования. Это не
входит в компетенцию НИИ и может быть реализовано в
сотрудничестве с индустриальными партнерами.
Ранее специалисты ИХБФМ СО РАН вместе с коллегами из ИОХ
РАН создали
высокоэффективный диагностикум
аспергиллезов (заболеваний, вызываемых низшими
грибами рода Aspergillus). Сейчас готов его прототип, и
специалисты Института органической химии РАН ведут переговоры с
фармацевтическими компаниями, чтобы начать производство
российской тест-системы аспергиллезов.
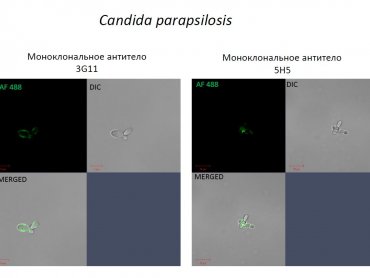
Иллюстрация: Иммунофлюоресцентная микроскопия
дрожжевых грибов вида Candida Papapsilosis, выявленных
моноклональными антителами 3G11 и 5H5, обладающими способностью
защитить мышей, зараженных смертельной дозой грибка
Candida/предоставлено Андреем Матвеевым
Источник: www.sbras.info




